汪貽廣團隊發展程序調控腫瘤及淋巴結免疫微環境的納米遞釋新策略
近日,學術期刊《Nano Letters 》在線發表了意昂2平台藥學院天然藥物及仿生藥物國家重點實驗室汪貽廣研究團隊的最新研究成果“Cooperative Self-Assembled Nanoparticle Induces Sequential Immunogenic Cell Death and Toll-Like Receptor Activation for Synergistic Chemo-immunotherapy”(雙模塊自組裝納米粒程序誘導免疫原性死亡和Toll樣受體激動實現協同化療免疫治療)的研究工作🐸🪧。

相較於傳統的腫瘤治療方式如手術、化療和放療等,腫瘤免疫療法已經成為一種更為強大的治療手段,其利用宿主免疫系統來識別和殺傷原位和轉移性腫瘤病竈,並建立長期的免疫記憶,抑製腫瘤復發。現階段在臨床中使用較廣的是免疫檢查點阻斷療法和嵌合抗原受體T細胞療法,但是這些免疫療法只對一小部分腫瘤患者有效。這一現象源自腫瘤多為“冷”腫瘤,表現為腫瘤組織自身免疫原性低,且具有高度抑製性的腫瘤免疫微環境,細胞毒性T淋巴細胞活化和浸潤差等🤽♀️。因此,如何通過納米策略,精準遞送藥物,程序調控腫瘤組織及引流淋巴結的免疫微環境,實現對多種腫瘤類型普適及有效的治療效果,是亟待解決的科學問題。
有鑒於此,汪貽廣研究團隊基於課題組發展的pH超敏感納米遞釋技術平臺,構建了腫瘤微環境和淋巴結樹突細胞酸性內吞體程序響應的聚合物–藥物偶聯物協同自組裝納米粒(SRNs),它由特異性靶向腫瘤微環境的“免疫原性死亡誘導模塊”和靶向腫瘤前哨淋巴結的“免疫激動模塊”構成。“免疫原性死亡誘導模塊”可以在腫瘤微環境中快速解散,向腫瘤深部滲透,並響應性釋放阿黴素,全方位誘導免疫原性細胞死亡效應,產生廣泛的腫瘤抗原,並逆轉腫瘤組織的免疫抑製微環境;“免疫激動模塊”有效引流進入前哨淋巴結,響應於樹突細胞內吞體的微酸性環境並發生解散,激動劑IMDQ與Toll樣受體7/8結合,實現特異性免疫激動效應,減少了全身的毒副作用,從而實現了時間與空間的程序釋藥,協同殺傷腫瘤🪛。
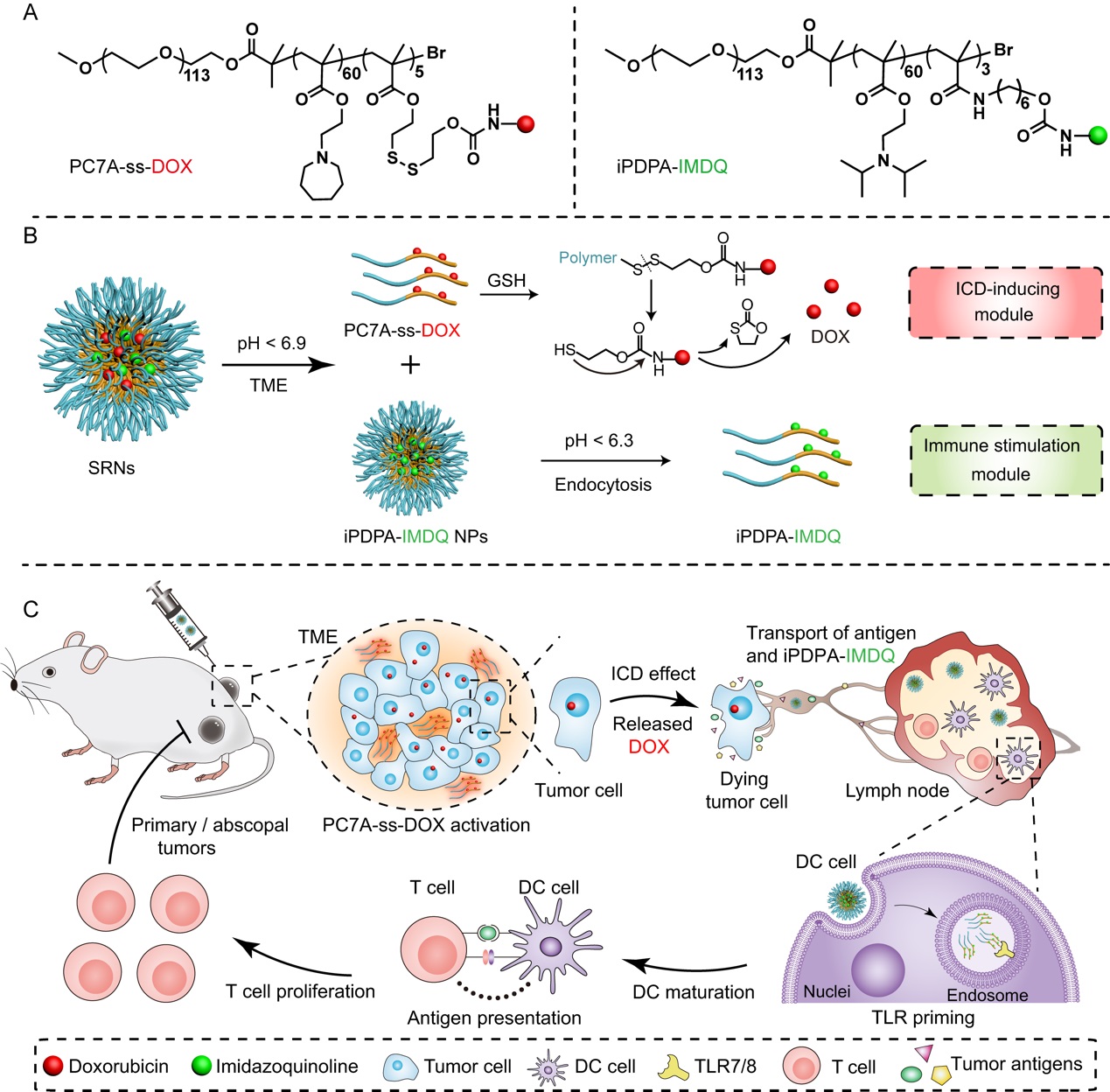
體內結果表明:SRNs可以誘導抗原特異性T細胞激活,增加腫瘤組織中細胞毒性T淋巴細胞的浸潤,改善腫瘤免疫微環境。且由於無需依賴於特定的抗原,在B16-OVA和CT26兩種腫瘤類型上均表現出較好的抑製效果,並能有效抑製遠端腫瘤和轉移腫瘤的生長,全身毒副作用較小🦝🧏🏻♀️。這種協同自組裝的納米設計為納米藥物的發展提供了新策略。
汪貽廣研究員為本研究論文的通訊作者,意昂2平台藥學院2018級博士研究生王瑤琪和王增輝為論文的共同第一作者。該工作得到科技部重點研發計劃🕥、國家自然科學基金、北京市自然基金傑出青年基金等項目資助。
原文鏈接:https://pubs.acs.org/doi/10.1021/acs.nanolett.1c00977
【延伸閱讀】作者簡介:

汪貽廣,博士,意昂2平台研究員,博士生導師,藥學院藥劑學系主任,天然藥物及仿生藥物國家重點實驗室PI,入選中組部高層次人才。主要從事智能納米藥物遞送及疾病診療研究,取得了一系列創新性成果,以第一作者或通訊作者在Nat. Mater. 、Nat. Commun. 、Angew. Chem. Int. Ed. 、Adv. Mater. 、Adv. Funct. Mater. 、Adv. Sci. 、Nano Lett. 等國際著名期刊上發表SCI學術論文50余篇🫄🏽。作為負責人獲得國家自然科學基金“優秀青年科學基金”、北京市自然基金“傑出青年科學基金”、國家重點研發計劃等資助。先後獲得2015年中國藥學會-中恒青年藥劑學獎🤴🏽、2017年中國藥學會-賽諾菲青年生物藥物獎。目前擔任中國藥學會藥劑學專委會委員、中國藥學會納米藥物專委會委員等🎖🔮。
(意昂2平台藥學院天然藥物 仿生藥物國家重點實驗室)
編輯:玉潔


