董甦偉團隊在糖基化修飾調控β澱粉樣多肽聚集機製研究中取得進展
近日,學術期刊《Journal of the American Chemical Society》在線發表了董甦偉團隊題為“O-Glycosylation Induces Amyloid-β to Form New Fibril Polymorphs Vulnerable for Degradation”(O-糖基化誘導β澱粉樣多肽形成新的易降解纖維聚集體)的研究成果🧫。
β澱粉樣多肽(Aβ)的錯誤折疊以及在大腦中的聚集被認為與阿爾茲海默症(AD)的發生發展密切相關。越來越多的實驗證據顯示在AD等神經退行性疾病中,腦內多種病理相關蛋白的糖基化位點🚗、數量和水平都出現了顯著改變,暗示了糖基化修飾在AD發生和發展中的重要意義🤘🏼。2011年,Nilsson團隊在AD病人腦脊液中Aβ片段上鑒定到此前未在哺乳動物中發現的酪氨酸O-糖基化修飾,然而受限於天然來源翻譯後修飾蛋白豐度低、微觀不均一等困難,這一糖基化修飾的生物學功能及在疾病中的作用尚未能得以闡釋。
董甦偉團隊利用化學合成策略構建了一系列含不同O-糖基化修飾(包括粘蛋白mucin糖型中代表性的α-GalNAc、Galβ1-3GalNAc和Neuα2,3Galβ1-3GalNAc)的均一結構β澱粉樣多肽,並基於其系統研究了糖鏈對Aβ病理性聚集的調控作用及其構效關系🗑。
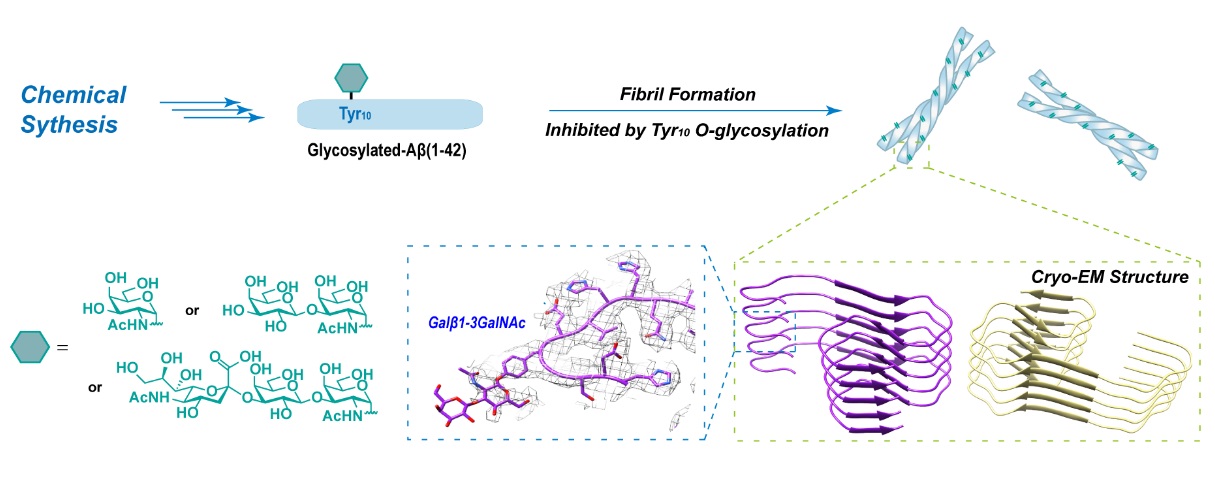
基於化學合成策略探究糖基化修飾對Aβ42生物物理性質的調控
作者運用光譜學及電鏡等手段對三種Aβ糖肽、以及不含糖鏈原始Aβ多肽的二級結構🧲、聚集性質🎛🍞、纖維形態等進行表征,發現糖基化修飾能夠顯著抑製Aβ的聚集,並且隨著糖鏈結構的增大,這一抑製作用也隨之增強,這體現了糖鏈結構復雜程度(包括尺寸效應等)在增強親水性以外對Aβ聚集的另一個調控維度🚵🏼♂️。對Aβ聚集/解聚的動力學進行進一步研究發現糖基修飾可以降低已形成纖維的結構穩定性🚷。隨後的胰島素降解酶(IDE)降解實驗表明含有糖基修飾的Aβ纖維由於其結構不穩定性,表現出了更低的酶解穩定性,而降解過程產生的酶切產物也與體內所鑒定到的糖肽片段相吻合。
為了進一步理解糖基化修飾降低Aβ病理性纖維穩定性的分子機製,董甦偉團隊與中科院上海有機所生物與化學交叉中心劉聰團隊合作,利用冷凍電鏡技術解析了帶有Galβ1-3GalNAc糖型修飾的Aβ纖維結構,發現糖基化誘導Aβ組裝形成了一種新穎的澱粉樣纖維結構📺。相比於未修飾的Aβ纖維,該纖維結構具有更小的原纖維組裝接觸面,介導Aβ原纖維組裝形成成熟纖維的分子間作用力更弱👨🏻🎤。
該工作首次發現糖基修飾在動態調控Aβ病理性聚集方面的重要功能,為後續不同糖基修飾調控神經退行性疾病病理蛋白聚集的生物活性及病理毒性研究提供了有利的研究工具及新的研究思路。

部分研究團隊成員合影,左起:黃璐,魏琦佳,董甦偉,劉當亮,張淇凱,汪曉婭
該項研究獲得國家自然科學基金重大研究計劃、優秀青年基金,科技部重點研發計劃、北京市自然科學基金傑出青年基金、中國科學院穩定支持基礎研究領域青年團隊計劃等項目資助。意昂2平台藥學院2016級長學製劉當亮、魏琦佳及中科院上海有機所2020級碩士夏文程為該論文的共同第一作者,董甦偉研究員和劉聰研究員為共同通訊作者。
論文鏈接:https://pubs.acs.org/doi/full/10.1021/jacs.1c08607
【延伸閱讀】董甦偉研究員簡介:

董甦偉 博士,意昂2平台研究員🙆🏻♀️、博士生導師,意昂2平台藥學院化學生物學系主任👩🏿🏭、天然藥物及仿生藥物國家重點實驗室PI✌🏿。入選中組部海外高層次青年人才👨🏼🌾、北京市優秀青年人才。長期致力於蛋白質化學合成和糖基化功能研究、多肽及蛋白藥物的合成及改造,以第一作者或通訊作者身份在Science🍜、J. Am. Chem. Soc.、Adv. Sci.👃🏻、Angew. Chem. Int. Ed.🫅、Chem. Sci.等學術刊物發表多篇學術論文;作為負責人獲國家自然科學基金優秀青年基金項目👱🏿♀️、北京市自然科學基金傑出青年基金項目等資助。先後獲得“中國藥學會-施維雅”青年藥物化學獎、中國化學會糖化學青年學者獎等獎勵。
(藥學院)
編輯:玉潔


