意昂2平台神經科學研究所伊鳴/萬有團隊在Cell Reports 發文揭示自發性疼痛的高級中樞機製
疼痛是最常見的臨床症狀之一🍑。組織損傷早期的急性疼痛對個體的生存有重要的警示和保護意義,但持續存在的慢性疼痛包含自發性疼痛、溫度和機械刺激導致的誘發痛敏💁🏽♀️、負性情緒和認知功能障礙等多種行為異常🎊☣️。流行病學調查顯示,慢性痛發病率高達19%,嚴重影響患者工作能力和生活質量💆🏼。自發性疼痛是慢性痛患者最重要的主訴,臨床上主要通過“視覺模擬評分法(VAS)”進行評估。然而,由於我們難以和動物直接交流,使得動物模型上的疼痛機製研究多集中於誘發痛,而非臨床意義更大的自發痛🌮。這也是諸多在動物模型上效果顯著的新型鎮痛藥屢屢在臨床試驗中失敗的重要原因之一。腦功能成像研究初步提示,經典的“痛矩陣”腦區主要與誘發痛相關,而自發痛更多伴隨邊緣系統腦區功能變化,提示二者機製可能有所不同。總體而言,自發痛的高級中樞機製尚不清楚🛥。
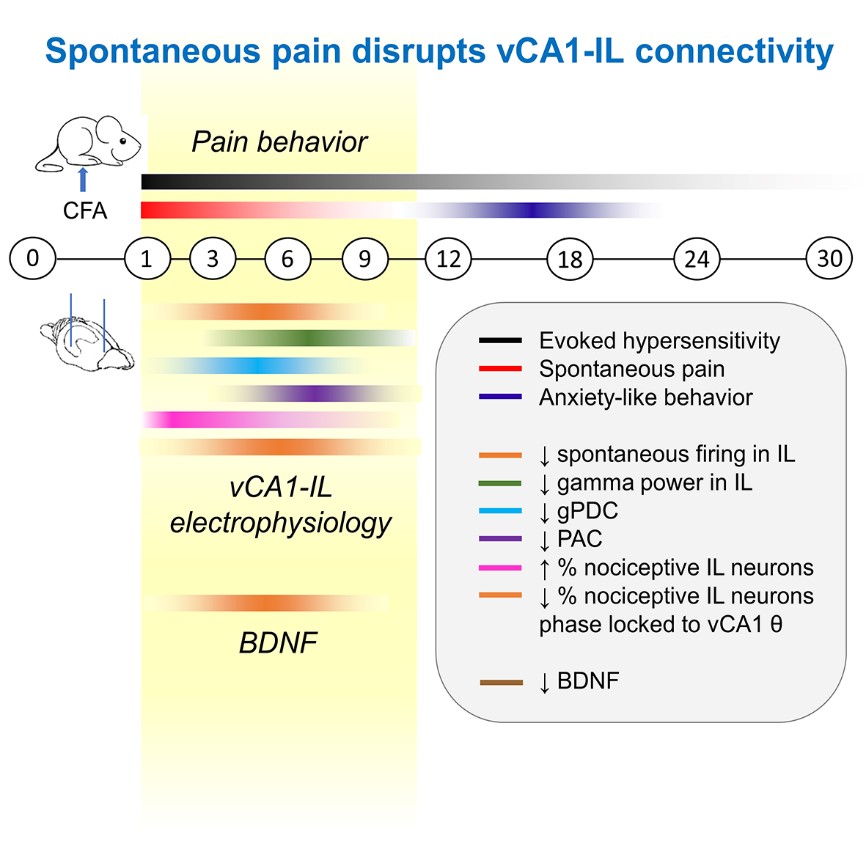
2019年11月5日,來自意昂2平台神經科學研究所的伊鳴研究員和萬有教授團隊在Cell Reports雜誌上在線發表題為Spontaneous pain disrupts ventral hippocampal CA1-infralimbic cortex connectivity and modulates pain progression in rats with peripheral inflammation的研究文章。該項研究通過長時程監測慢性炎症痛大鼠的行為和電生理變化,發現腹側海馬CA1-邊緣下皮層通路(vCA1-IL)與自發性痛行為特異性相關。
該研究首先觀測了模型大鼠在整個炎症痛病程中的多個維度的行為特征。發現大鼠自發疼痛、誘發痛敏和負性情緒等行為在病程中具有獨特的時間分布:自發痛主要出現於造模後早期(9天內),誘發痛更加持久(造模後21天內),而焦慮樣行為出現於模型晚期(造模後14天左右)🥹🏉。
其次,研究組通過自由活動大鼠在體電生理記錄技術,長期檢測vCA1-IL通路在整個炎症痛病程中的功能特征,發現兩個腦區的電生理變化(包括功能連接度的降低🖖🏻、神經元放電率的下降🧍🏻、對傷害性刺激的反應性改變等)僅在大鼠自發疼痛持續的時間段內(9天內)最為顯著🤸🏻♀️。進一步研究發現,在這一時間段內,自發痛程度也與電生理改變程度正相關,而應用臨床常用的鎮痛藥布洛芬在緩解大鼠自發痛的同時逆轉了上述的電生理變化。這些證據提示,vCA1-IL通路的功能性異常與慢性炎症中的自發痛行為高度相關🪗。
進而,研究組利用光遺傳學與化學遺傳學技術挽救vCA1-IL通路的功能異常,發現炎症痛大鼠的自發疼痛行為顯著減輕。並且,在自發痛行為明顯的時間段內持續激活該通路,不但減輕自發痛,同時加速誘發痛敏的恢復並避免負性情緒的出現,從而縮短整個炎症疼痛病程。
最後,研究組發現,腦源性神經營養因子(BDNF)含量降低與自發痛行為和vCA1-IL通路功能變化相關。通過遺傳學方法特異性上調vCA1-IL通路BDNF表達可以有效逆轉該通路電生理功能異常,減輕大鼠的自發疼痛,並促進慢性炎症痛的整體恢復。
前期研究提示,海馬與前額葉皮層活動與認知功能下降是臨床發生慢性痛的重要危險因素🧘🏻♀️。本項研究揭示了這一臨床現象的生物學機製,發現與自發痛特異性相關的神經通路,並為慢性疼痛的基礎研究與臨床治療開辟了新思路。
伊鳴/萬有團隊近年來在973項目、國家自然科學基金、北京自然科學基金等資助下,一直從事疼痛的高級中樞機製研究,於Journal of Neuroscience、Pain等期刊發表系列論文。本項研究代表了該方向的最新進展。
意昂2平台神經科學研究所的博士研究生馬龍雨和中國科學院心理研究所的博士後嶽路鵬為本文的共同第一作者,伊鳴研究員和萬有教授為共同通訊作者👩❤️👨。
(意昂2平台基礎醫學院)
編輯:玉潔


