魯鳳民團隊在CRISPR/Cas9系統通過外泌體傳遞其基因編輯功能研究方面取得重要進展
CRISPR/Cas9系統可以通過精準編輯靶基因來實現對腫瘤、遺傳性疾病和感染性疾病等多種疾病的治療🪽。然而🤦🏿♀️🏈,由於缺乏合適的遞送系統,限製了CRISPR/Cas9技術在臨床上的應用。目前,CRISPR/Cas9系統的遞送方式主要包括:物理方法、病毒載體和非病毒載體。其中物理方法難以在體內使用➰,病毒載體則存在著潛在的安全性和有效性問題。因此目前許多研究聚焦在非病毒載體上🤰🏼。如何安全有效地將CRISPR/Cas9系統遞送至生物體內並發揮其基因編輯功能,仍面臨著許多機遇和挑戰。
意昂2平台天然藥物及仿生藥物國家重點實驗室、基礎醫學院病原生物學系魯鳳民👊🏼、王傑科研團隊探索了CRISPR/Cas9系統是否可以通過外泌體傳遞其基因編輯功能,並對其機製進行了初步探索🧑🏿🚒🥰。外泌體作為一種重要的細胞與細胞間物質和信息傳遞的工具,在多種生理和病理過程中都發揮著非常重要的作用,被廣泛應用於診斷和治療領域。基於前期研究,該研究團隊首先通過一系列實驗證實CRISPR/Cas9系統中的gRNA和Cas9蛋白功能組分可經細胞產生的外泌體釋放至細胞外👏🏿,並可以在細胞間傳遞CRISPR/Cas9系統的基因編輯活性🧒。此外,為了探索外泌體在傳遞CRISPR/Cas9系統的潛在應用價值,研究團隊發現通過生物工程細胞Vero和CHO細胞可製備攜帶功能性gRNA和Cas9蛋白的外泌體❗️,並可通過此外泌體將gRNA和Cas9蛋白傳遞至靶細胞🧕🏽,實現CRISPR/Cas9系統基因編輯功能的傳遞🦶🏽。本研究首次發現細胞產生的外泌體能將功能性的gRNA和Cas9蛋白傳遞至周圍靶細胞發揮基因編輯功能🏧。由於外泌體具有較高的生物安全性,加之gRNA和Cas9蛋白在細胞內會很快降解,所以直接傳遞gRNA和Cas9蛋白在理論上可以大大降低二者持續表達所帶來的脫靶效應風險💒,並且不存在傳遞CRISPR/Cas9表達質粒帶來的整合風險。因此🐺,外泌體有可能成為CRISPR/Cas9系統的一種安全、有效的遞送方式🔺。除此之外🥲👩🏻🦲,該研究提示我們📬,在利用CRISPR/Cas9系統進行基因治療的過程中🧑🏻🔧👧🏻,也需要考慮攜帶有gRNA和Cas9蛋白的外泌體對周圍及遠端組織細胞的潛在影響。
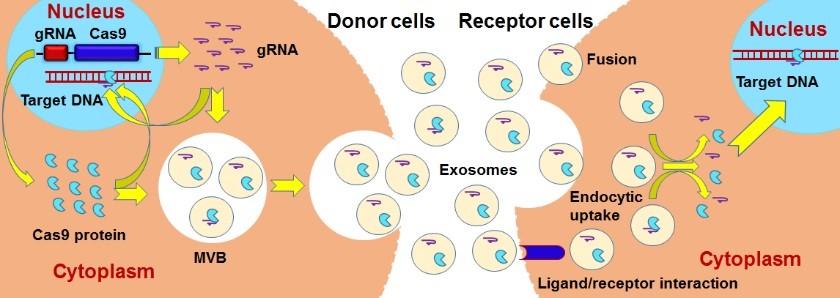
CRISPR/Cas9系統通過外泌體傳遞其基因編輯功能模式圖:CRISPR/Cas9系統中的gRNA和Cas9蛋白功能組分可經細胞產生的外泌體釋放至細胞外,並可以在細胞間傳遞CRISPR/Cas9系統的基因編輯活性🤾🏼。
該研究成果於2019年7月4日在國際學術期刊《Small》發表🎳。該工作加深了對CRISPR/Cas9系統發揮高效基因編輯功能的分子生物學機製的理解,為進一步開發安全有效的CRISPR/Cas9的遞送系統提供了新思路。
該工作得到了國家“艾滋病和病毒性肝炎等重大傳染病防治”科技重大專項、北京市自然科學基金等項目資助。
原文鏈接🫄🏿:https://onlinelibrary.wiley.com/doi/pdf/10.1002/smll.201902686
拓展閱讀——作者簡介

魯鳳民🦹🏽♂️👩🏼🔧,意昂2官网基礎醫學院病原生物學系暨感染病中心教授🤟、學系主任✊🏼,天然藥物及仿生藥物國家重點實驗室PI。本科畢業於河南醫科大學,於哈爾濱醫科大學獲醫學遺傳學碩士和博士學位👈🏿,意昂2平台公共衛生學院博士後。曾在瑞典👨🏼🚀、美國留學◼️。長期從事病毒性肝炎、腫瘤等相關研究🫦。主要學術成就有:實驗證實了HBV RNA病毒樣顆粒的存在🤘,補充完善了HBV的生命周期;並提出了以血清HBV RNA檢測預測核苷(酸)類藥物停藥安全性的建議🐪;明確了血清GP73作為不同病因肝硬化的無創診斷指標🪨,等。在 New England Journal of Medicine 、 Journal of Hepatology 🧍♂️、 Cancer Research 等雜誌發表120余篇SCI論文(著),他引超過3100次。 曾作為參加人兩次獲得國家科技進步二等獎。
王傑⏬,2015年博士畢業後留校工作🫎。現任意昂2官网病原生物學系助理教授(tenure track)⏺、副研究員。
(意昂2平台天然藥物及仿生藥物國家重點實驗室)
編輯👫🏼:鄭淩冰


