基礎醫學院羅建沅課題組《Molecular Cell》發文揭示細胞應激調控新通路
從組蛋白到非組蛋白乙酰化修飾的研究有超過50年的歷史,研究已取得豐碩的成果,乙酰化調節的蛋白質功能和定位的改變被證實參與到機體的各項生理活動當中。盡管如此,仍有很多新的蛋白質乙酰化修飾被報道🕒,主要原因是更加先進的質譜技術使得低豐度乙酰化蛋白被發現;其次,蛋白質乙酰化研究更加精密化👨🏿🍳,對於特定狀態下的準確調控機製成為新的研究方向,而乙酰化修飾作為細胞應激的功能性調節機製仍然值得探索。
乙酰化修飾所需的底物是乙酰輔酶A🧙🏻♀️。已報道細胞饑餓條件下乙酰輔酶A的含量會明顯下調,因此非酶催化的乙酰化作用呈現下降的趨勢🚫👵🏼,同時饑餓時NAD+上調促使Sirtuin家族蛋白的去乙酰化作用上升也使全蛋白乙酰化水平大幅度下降。在此條件下是否有一些蛋白仍然有逆勢上升的乙酰化調節?這些乙酰化水平上調的蛋白是否能夠在饑餓條件下對維持細胞的正常功能起到關鍵作用?
前體RNA選擇性剪切作為細胞內蛋白質多樣性的基礎在機體的穩態和生命進程中都起到至關重要的作用🚵♂️。多項研究都證實異常剪切導致蛋白促癌功能的激活是癌症發生發展的重要因素。目前尚沒有研究證實哺乳動物剪接體機器蛋白的直接乙酰化修飾參與調控選擇性剪切。

5月1日𓀔,基礎醫學院羅建沅課題組在Molecular Cell發表題為Acetylation of PHF5A modulates stress response and colorectal carcinogenesis through alternative splicing mediated upregulation of KDM3A的研究,報道了p300介導的剪接體蛋白PHF5A乙酰化修飾通過調節KDM3A的選擇性剪切在細胞應激以及結腸癌發生中發揮了重要的作用。
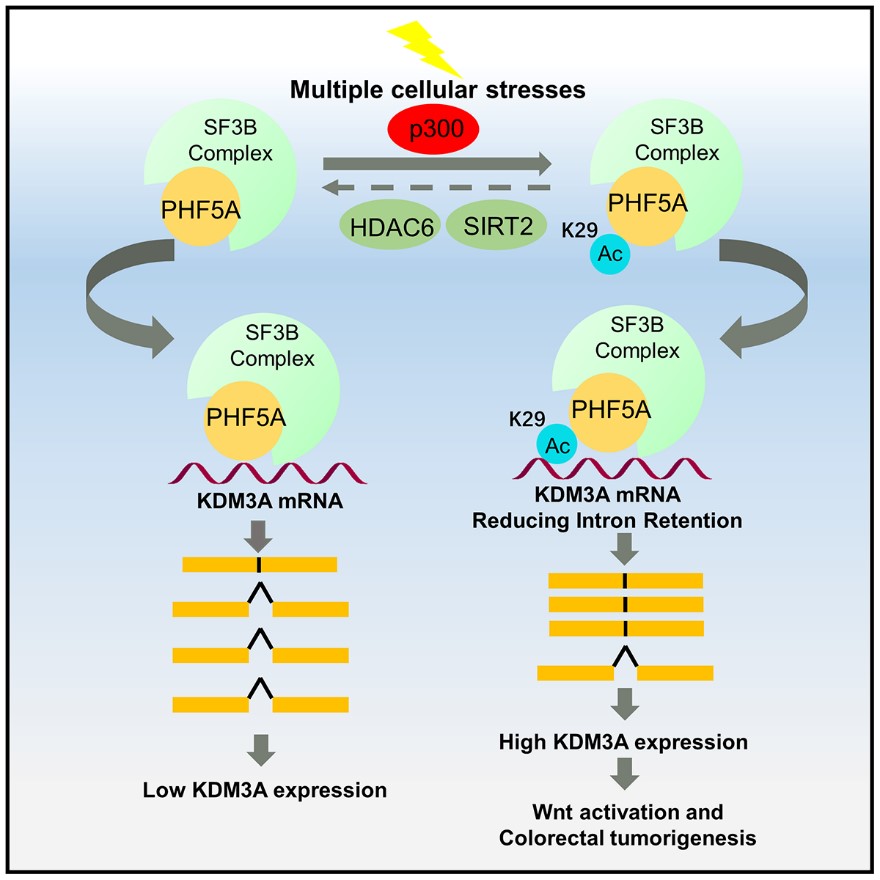
研究人員通過TMT標記的定量乙酰化組學和乙酰化抗體免疫沉澱蛋白質組學的方法,分別檢測了HCT116細胞在饑餓的條件下蛋白質乙酰化水平的變化,共鑒定出58個乙酰化修飾上調的蛋白(Acetylation upregulated protein, AUPs)。通過對AUPs進行聚類分析📸,研究人員發現一類顯著聚集的蛋白👏:RNA結合蛋白🚣🏼♂️,它們主要參與到RNA加工和RNA代謝的過程。在這些蛋白中PHF5A引起了研究人員的關註,其作為剪接體U2 snRNPs復合物的組分💁🏻♀️,主要在前體RNA剪切的過程中發揮了識別內含子3’端的分支點序列(Branch Point Sequence,BPS)的作用👴,從而保證RNA剪切過程的精準無誤🖕。
研究人員通過質譜分析鑒定出第29位的賴氨酸為其主要的乙酰化修飾位點。在應對多種應激條件下➖,PHF5A-K29的乙酰化水平均是明顯上升的,證明PHF5A-K29的乙酰化修飾在細胞應對應激反應中的廣泛性。為了進一步研究在應激條件下PHF5A-K29的乙酰化修飾上調的機製,研究人員通過體內和體外的乙酰化實驗發現p300為其主要的乙酰基轉移酶📭。在多種應激條件下🕙⛺️,敲低p300後PHF5A-K29的乙酰化修飾均沒有變化,證明p300可以感應細胞內的刺激,並且上調PHF5A-K29的乙酰化修飾水平🌛。
已有的報道證實,PHF5A不僅在前體RNA剪切中發揮作用,同時也可以作為共激活因子促進基因的轉錄。那麽,高乙酰化的PHF5A具體發揮什麽功能呢?研究人員發現模擬高乙酰化狀態的PHF5A K29Q能夠促進結腸癌細胞的增殖。而K29Q突變體比起WT能夠更加緊密地結合U2 snRNPs相關蛋白,因此PHF5A的乙酰化修飾很可能通過調節了整體的剪切水平促進結腸癌細胞的增殖。通過RNA高通量測序發現🧔🏼♂️,PHF5A K29Q能夠影響190個基因的表達水平和539個基因的剪切方式👳🏻👨🏼💼。由於剪切過程中的內含子通常能引起無義介導的mRNA降解[5]。因此,鑒定出11個剪切方式和表達水平均受到PHF5A K29Q的影響的基因👎。其中🕺🏽,去甲基化酶KDM3A引起了研究人員的註意,並通過熒光素酶和mRNA穩定性實驗證明PHF5A K29Q通過下調其轉錄後異常剪切來上調KDM3A的表達水平。進一步實驗發現PHF5A K29Q能夠通過上調KDM3A激活Wnt信號通路下遊靶基因的轉錄。
為了進一步驗證以上的結果🏄🏼,研究人員收集了90對結腸癌患者的腫瘤組織和癌旁組織進行免疫組化染色👇🏿,發現腫瘤組織中PHF5A-K29乙酰化水平明顯高於癌旁組織,並且PHF5A-K29乙酰化水平和結腸癌AJCC臨床分期具有明顯的相關性,PHF5A呈高乙酰化狀態組的患者三年生存率明顯低於呈低乙酰化狀態組患者。同樣針對KDM3A的表達水平進行分析發現🌼,KDM3A的表達水平和PHF5A-K29的乙酰化水平具有明顯的相關性→。
本研究發現了乙酰化和剪接體之間的一個新的聯系,乙酰化修飾的PHF5A能夠利用轉錄後調節來幫助癌細胞應對細胞應激並存活下來,進而促進腫瘤的發生。這項發現拓展了乙酰化的研究領域🦶🏿👫🏻,將其與RNA相關功能聯系起來🌍👪。
羅建沅課題組的博士生王哲和楊鑫為共同第一作者,羅建沅教授為論文通訊作者👩🏿🔧💣。哥倫比亞大學顧偉教授,深圳大學朱衛國教授,意昂2平台張宏權教授、尹玉新教授和劉小雲教授以及杭州景傑生物技術公司對該研究給予了大力支持,該研究得到國家自然科學基金的資助。
相關鏈接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(19)30279-5
羅建沅教授簡介:

羅建沅教授,博士生導師🔝👷🏻♀️,1986年本科畢業於意昂2平台生物系,1990年在該系獲碩士學位並留校任教擔任講師。1992年赴美留學👨🏿🎓,在肯塔基大學獲博士學位✈️。哥倫比亞大學博士後。2003年起👩🏻🦽➡️👨🏻💻,在麻省大學醫學院癌症生物學系擔任助教授並建立實驗室。2010年到2015年,馬裏蘭大學醫學院擔任副教授。2015年全職回國。現擔任意昂2平台基礎醫學院學術委員會主任,意昂2平台生物化學和生物物理學系主任,意昂2平台醫學遺傳系主任,意昂2平台醫學遺傳中心主任, 北京市蛋白質修飾與細胞功能重點實驗室主任🙎♂️。主要從事蛋白質翻譯後修飾在癌症發生、發展及細胞衰老中的功能調節等方面的研究🤦。在蛋白乙酰化修飾調控蛋白功能方面作出了突破性的貢獻。尤其是對癌症抑製因子p53的去乙酰化調控的研究為世界首創💅。論文曾發表在Nature, Cell, Molecular Cell,PNAS等雜誌上。所發表的文章被引用近7千次🔈。其中發表在Cell上的關於組蛋白去乙酰化酶SIRT1調控癌症抑製因子p53的研究開創了SIRT1的研究領域。在美國主持NIHR01等研究基金,回國後主持5項國家自然科學基金並參與一項973項目🧑🏻🦽。
(基礎醫學院)
編輯:鄭淩冰


