羅建沅團隊發現蛋白質去琥珀酰化酶SIRT5在絲氨酸代謝中的重要作用
2017年11月28日🧖🏿,意昂2平台基礎醫學院羅建沅教授課題組在《Cancer Research》在線發表題為“SHMT2 desuccinylation by SIRT5 drives cancer cell proliferation”的研究論文👆🏿,首次報道了SIRTUIN家族成員SIRT5蛋白通過對線粒體絲氨酸羥甲基轉移酶(SHMT2) 的去琥珀酰化修飾調控癌細胞內絲氨酸代謝以及一碳循環,為闡釋癌細胞如何進行絲氨酸的過度利用以維持自身迅速增殖提供了重要線索。羅建沅教授為該文通訊作者🧙🏿♂️,其直博研究生楊鑫為第一作者。
SHMT2是一種磷酸吡哆醛(PLP)結合蛋白🧺,它催化絲氨酸與四氫葉酸反應產生5🛌🏽,10-亞甲基四氫葉酸和甘氨酸,為嘧啶的從頭合成提供重要原料。最近的研究表明⚆,絲氨酸分解代謝能驅動一碳循環進行,一碳循環的多種中間產物能夠在核苷酸生物合成、維持細胞內氧化還原穩態以及癌細胞生長中起重要作用🚙。而SHMT2作為關鍵蛋白能夠調節絲氨酸分解代謝和一碳循環,敲低SHMT2表現出明顯的對癌細胞生長和侵襲抑製。
SIRT5屬於SIRTUIN家族,是一種NAD依賴的賴氨酸去乙酰化酶🧑🏼🦳✊🏻,並同時具有去琥珀酰化酶🪁、去丙二酰化酶和去戊二酰化酶的活性,能調節多種細胞代謝途徑,包括氨相關代謝💂🏿♀️、脂肪酸氧化和糖酵解等🙅🏼♂️🫗。但是SIRT5在非必需氨基酸代謝中的功能仍然不明確。
本研究中,課題組純化出SIRT5相關的蛋白質復合體,並用質譜鑒定出大量的SIRT5底物,總結出多條未知的與SIRT5相關的代謝通路(如糖基化🍄🟫,代謝物轉運等)👨👩👦👦。進一步的研究發現,SIRT5在絲氨酸分解代謝中起到不可替代的調控作用👮🏽。本研究通過生物化學實驗確定了SHMT2作為SIRT5去琥珀酰化底物,SHMT2第280位的賴氨酸被鑒定出是主要的琥珀酰化位點。SHMT2在低琥珀酰化修飾情況下,其生物學催化活性明顯升高。在絲氨酸甘氨酸饑餓情況下,SIRT5與SHMT2直接作用,使其280位賴氨酸去琥珀酰化,從而促進SHMT2有催化活性的四聚體產生🧑🏽🦱,而上調其酶活性🕵🏿♂️。SHMT2失活的單點突變K280E細胞系表現出絲氨酸代謝阻斷以及甘氨酸積累的特性🤵🏽♂️,不僅損害癌細胞中氧化還原穩態🕜,也能直接抑製癌細胞在細胞模型或小鼠模型中的生長(如圖所示)🤸🏽。
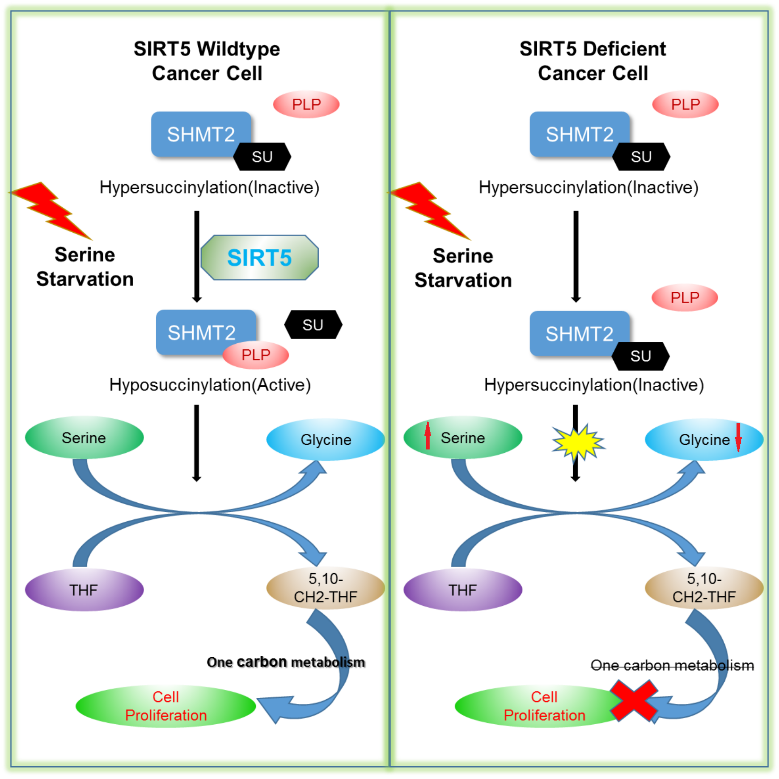
綜上所述,SIRT5通過控製SHMT2的琥珀酰化修飾調節癌細胞增殖🧑🏿🎤👩🏿🌾,不僅加深了對於線粒體SIRTUIN蛋白功能的了解,也為探索癌症治療提供了新的思路⏯,為開發新藥提供了新的靶點𓀚。該研究項目得到國家自然科學基金、國家重點基礎研究發展計劃(973計劃)的支持。
論文鏈接😬: http://cancerres.aacrjournals.org/content/early/2017/11/23/0008-5472.CAN-17-1912.article-info
(基礎醫學院)
編輯:玉潔


