楊吉春教授團隊在糖尿病發病機製領域取得系列重要發現
最近,內分泌-糖尿病領域的權威刊物Diabetes連續在線發表了基礎醫學院楊吉春教授團隊的兩篇研究論文,揭示以FAM3基因家族成員FAM3A及FAM3C為核心的非胰島素依賴糖脂代謝調控網絡🛌🏿。
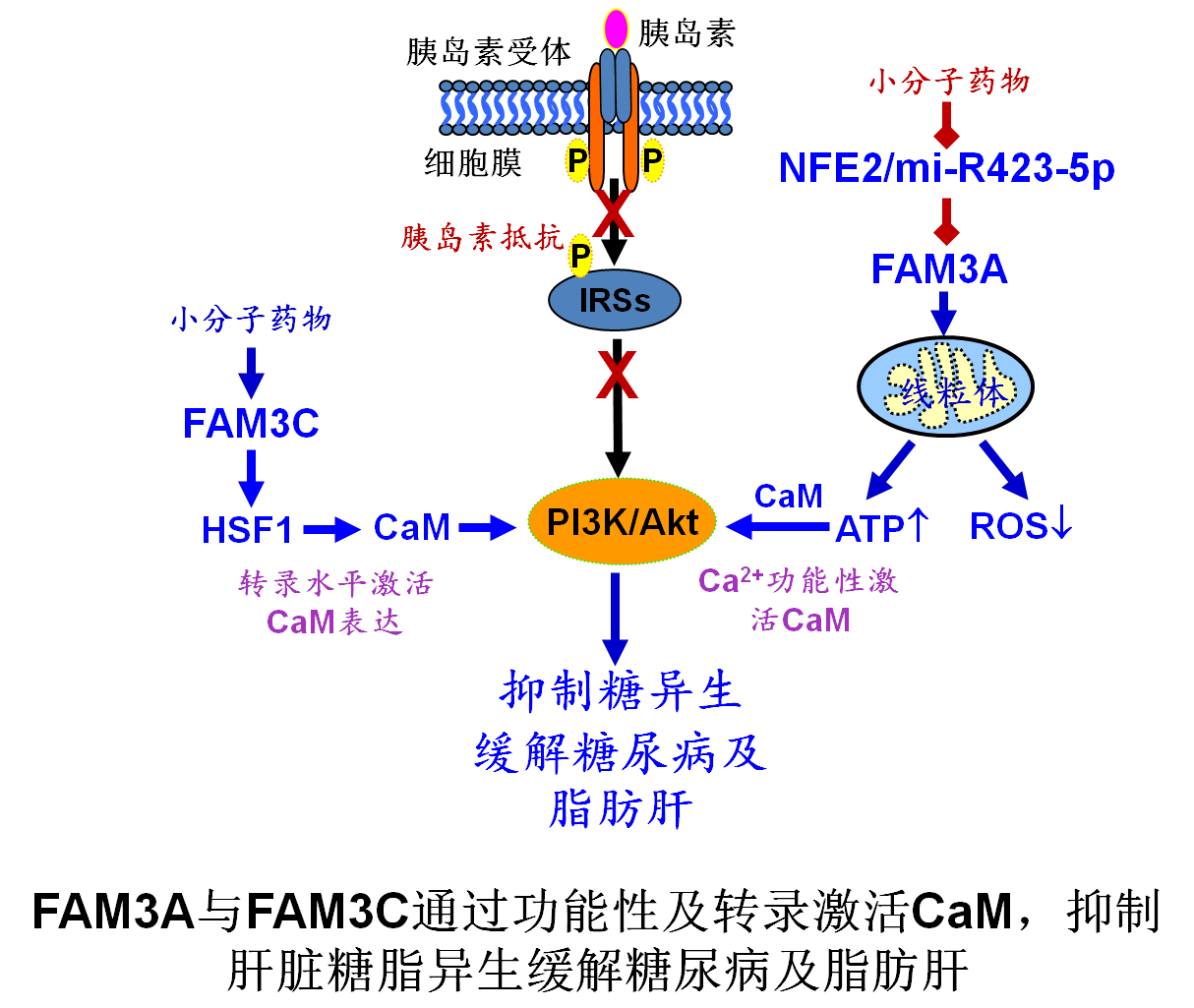
課題組在前期研究中已揭示FAM3A是一個新線粒體蛋白,其在肝臟表達受抑製在2型糖尿病及非酒精性脂肪肝發生過程中起重要作用。然而,糖尿病發生時🖖,肝臟FAM3A表達受抑製的機製尚不清楚(Hepatology 2014)。結合生物信息學預測和一系列細胞生物學手段,證實FAM3A是miR-423-5p的靶基因。miR-423-5p可直接抑製FAM3A-ATP-CaM通路。在脂肪肝患者及糖尿病小鼠肝臟中,miR-423-5p表達異常升高😔。在糖尿病小鼠肝臟中抑製miR-423-5p可改善高血糖及脂肪肝🧙🏻♂️🛻,而在正常小鼠肝臟中過表達miR-423-5p則導致肝臟糖脂代謝異常👊🏻。在脂肪肝患者及糖尿病小鼠肝臟中🙎🏻♀️,NFE2表達水平明顯增加。肥胖發生時,肝臟NFE2表達被激活,其通過誘導miR-423-5p表達抑製FAM3A-ATP-Akt通路,導致肝臟及全身糖脂代謝紊亂。抑製NFE2/miR-423-5p信號軸激活FAM3A表達有可能成為2型糖尿病的新幹預策略( Diabetes 2017 Apr 14. doi: 10.2337/db16-1172. [Epub ahead of print]. http://diabetes.diabetesjournals.org/content/early/2017/04/13/db16-1172.long, 博士生楊衛利是論文第一作者,楊吉春為論文通訊作者)🤽🏽♀️🤹。目前🧑🎄,已篩選到數種激活FAM3A表達的小分子🌊,其顯示了良好的抗糖尿病、脂肪肝及肥胖效果(待投稿)。
在糖尿病小鼠肝臟組織中🤦🏽♀️,FAM3基因家族另一成員FAM3C表達也顯著降低。在糖尿病小鼠肝臟特異性過表達FAM3C基因後,小鼠高血糖、全身胰島素抵抗及脂肪肝症狀顯著緩解。在糖尿病小鼠肝臟過表達FAM3C抑製糖脂異生關鍵基因的表達。FAM3C通過誘導CaM表達進而激活Akt🚴🏽,且這一過程不依賴胰島素及細胞外Ca2+內流🤚🏻。研究進一步揭示FAM3C通過激活HSF1調控CALM1表達😨。抑製HSF1😄,能反轉FAM3C對CALM1表達😓、Akt激活及糖異生抑製的作用💦。在激活Akt通路的同時,FAM3C還抑製mTOR-SREBP1C-FAS通路,抑製肝臟脂質合成👩🏿🚀,緩解脂肪肝。本研究揭示了在肥胖狀況下🌠,肝臟FAM3C表達下降將會抑製HSF1-CaM通路,導致糖代謝和脂代謝失調,而恢復FAM3C-HSF1-CaM信號通路有利於改善肝臟糖脂代謝異常🫷🏼。( Diabetes 2017 Feb 28. doi: 10.2337/db16-0993. [Epub ahead of print], http://diabetes.diabetesjournals.org/content/early/2017/02/27/db16-0993.long,博士生陳真真和碩士生丁立偉是論文共同第一作者,楊吉春為論文通訊作者)🏊🏽♂️🦍。目前,已篩選到了幾種能激活FAM3C表達的小分子🙇🏿♂️,正在評估其抗糖尿病效果。
隨著糖尿病病情的發展,胰島素抵抗及胰島功能衰竭進行性加重💁🏽♀️💩,現有的很多幹預藥物往往難以有效控製血糖🤽🏼♀️。該系列研究揭示FAM3A及FAM3C分別從功能性激活及轉錄水平激活CaM-Akt通路,以非胰島素依賴途徑抑製肝臟糖異生過程🙏🏿,緩解高血糖💁🏻♂️,為伴隨嚴重胰島素抵抗的2型糖尿病及脂肪肝患者治療提供了數個潛在的幹預靶點。
本課題受國家基金委優秀青年基金及面上項目🤶🏻🧚🏼♂️、科技部慢性病項目及北京市重點項目資助🅾️👩🌾。楊吉春團隊己在Hepatology、Diabetes、ATVB🫏、J.B.C、JMCC、BBA及Nutr Rev等國際著名期刊上發表SCI論文50余篇,總影響因子約360🤙🏽,其中第一及通訊作者論文32篇。近年來以通訊作者身份在Hepatology、Diabetes🦍、NAR等國際著名期刊上發表研究論文21篇,總影響因子約120。
(基礎醫學院)
編輯:玉潔


